2022年3月28日
国立研究開発法人国立がん研究センター
国立研究開発法人日本医療研究開発機構
発表のポイント
- 国内で実施した医師主導治験の結果をもとに、世界で初めてとなる、HER2陽性大腸がん患者さんに対するペルツズマブとトラスツズマブの併用療法が日本で承認されました。
- HER2陽性大腸がんは希少なサブタイプ*1で、これまで国内外ともに承認された有効な治療法がありませんでした。
- 今回の結果は、アンメットメディカルニーズ*2のHER2陽性大腸がんに対して、アカデミアが主導した治験とSCRUM-Japan*3レジストリ研究*4の結果により、新たな治療法を確立した成功例です。
概要
国立研究開発法人国立がん研究センター(理事長:中釜 斉、東京都中央区)東病院(病院長:大津 敦、千葉県柏市)は、腫瘍組織検査(IHC法*5及びFISH法*6)またはリキッドバイオプシー(血液を用いてがんのゲノム異常を検出する検査)でHER2陽性大腸がんと診断された患者さんに対して、抗HER2抗体療法であるペルツズマブとトラスツズマブの併用療法の有効性と安全性を評価する医師主導治験(TRIUMPH試験、EPOC1602)を実施しました。
本試験の結果、全体の約30%でがんの明らかな縮小が認められ、あらかじめ設定した有効性の基準を上回る結果を確認しました。本試験の結果に基づき、ペルツズマブとトラスツズマブを製造販売する中外製薬株式会社から2021年4月にペルツズマブとトラスツズマブの併用療法の承認申請が行われ、このたび、2022年3月28日に薬事承認されました。また、TRIUMPH試験のスクリーニング研究で用いられたHER2検査に基づきベンタナ ultraView パスウェー HER2(4B5)(ロシュ・ダイアグノスティックス株式会社、IHC法)及びパスビジョンHER-2 DNAプローブキット(アボットジャパン合同会社、FISH法)がそれぞれコンパニオン診断薬*7として2022年3月に薬事承認されています。
これまで、国内外で確立した大腸がんの個別化治療の対象は、RAS野生型、BRAFV600E変異、高度のマイクロサテライト不安定性(MSI-H)を有する患者さんのみでした。本試験の成果により、ここに新たにHER2陽性大腸がん患者さんに対する治療法が加わり、より多くの患者さんに個別化治療を届けられることが期待されます(図1)。
国立がん研究センター東病院は、製薬企業が積極的に取り組みにくい希少なサブタイプに対して有効な治療法を開発するため、SCRUM-Japanの基盤を活用してスクリーニングプラットフォームの構築や医師主導治験の実施に積極的に取り組んできました。今後も一人でも多くの患者さんが最善の治療を受けられるよう、がん個別化治療の実現を目指してまいります。
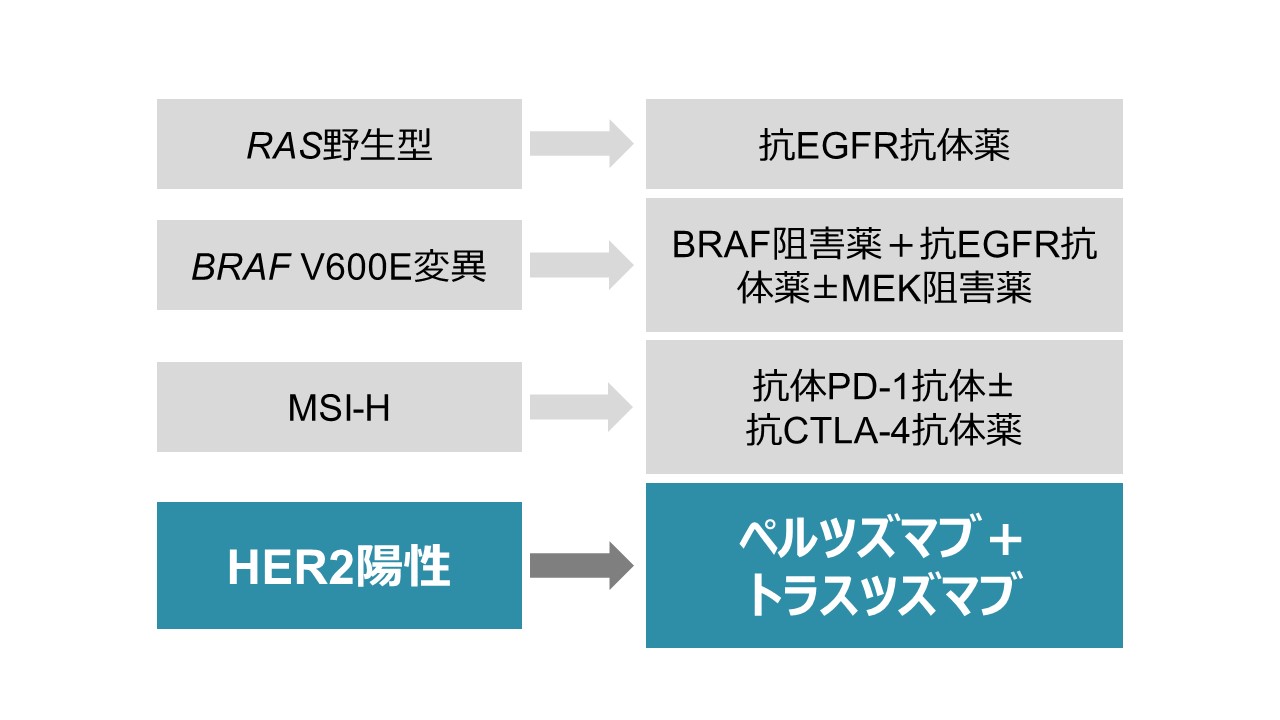 図1:大腸がんの個別化治療
図1:大腸がんの個別化治療
ペルツズマブとトラスツズマブの併用療法における薬事承認内容
ペルツズマブ 今回の承認に関する添付文書情報
効能又は効果:がん化学療法後に増悪したHER2陽性の治癒切除不能な進行・再発の結腸・直腸癌
用法及び用量:がん化学療法後に増悪したHER2陽性の治癒切除不能な進行・再発の結腸・直腸癌にはトラスツズマブ(遺伝子組換え)との併用において、通常、成人に対して1日1回、ペルツズマブ(遺伝子組換え)として初回投与時には840mgを、2回目以降は420mgを60分かけて3週間間隔で点滴静注する。なお、初回投与の忍容性が良好であれば、2回目以降の投与時間は30分間まで短縮できる。
トラスツズマブ 今回の承認に関する添付文書情報
効能又は効果:がん化学療法後に増悪したHER2陽性の治癒切除不能な進行・再発の結腸・直腸癌
用法及び用量:がん化学療法後に増悪したHER2陽性の治癒切除不能な進行・再発の結腸・直腸癌にはペルツズマブ(遺伝子組換え)との併用でB法を使用する。
B法:通常、成人に対して1日1回、トラスツズマブ(遺伝子組換え)として初回投与時には8mg/kg(体重)を、2回目以降は6mg/kgを90分以上かけて3週間間隔で点滴静注する。なお、初回投与の忍容性が良好であれば、2回目以降の投与時間は30分間まで短縮できる。
本試験(TRIUMPH試験、EPOC1602)の結果
TRIUMPH試験は、治療に抵抗性となった治癒切除不能な進行・再発のHER2陽性大腸がん患者さんを対象に、ペルツズマブとトラスツズマブの併用療法の有効性と安全性を評価する多施設共同第II相医師主導治験です。国立がん研究センター東病院を中心に、全国7施設*8で実施されました。
ペルツズマブとトラスツズマブの併用療法について、腫瘍組織遺伝子パネル検査でHER2陽性の患者さんで30%(27例中、部分奏効以上が8例)、リキッドバイオプシーでHER2陽性の患者さんで28%(25例中、部分奏効以上が7例)の奏効割合が得られました。これらの結果は、あらかじめ設定した有効性評価基準(25例中5例以上の部分奏効)を上回るものでした。
またSCRUM-Japanレジストリに登録されたHER2陽性大腸がん患者さんのうち、本試験に参加された患者さんと同様の基準を満たした13例に対しては、従来の抗がん剤治療が行われましたが、腫瘍の縮小は全く認められませんでした。従って、ペルツズマブとトラスツズマブの併用療法は、治療に抵抗性となったHER2陽性大腸がん患者さんにとって、従来使用されていた抗がん剤と比べて優れた有効性がある可能性が示唆されました。なお本研究成果は米国科学雑誌「Nature Medicine」オンラインに日本時間2021年11月12日付けで掲載されました。
参考)2021年11月12日プレスリリース
HER2陽性大腸がんに対する抗HER2抗体併用療法の有効性を確認
参考)論文情報
- 雑誌名: Nature Medicine
- タイトル: Circulating tumor DNA-guided treatment with pertuzumab plus trastuzumab for metastatic colorectal cancer with HER2 (ERBB2) amplification: the TRIUMPH phase 2 Trial (EPOC1602)
- 著者:Yoshiaki Nakamura.,et al.
- DOI:10.1038/s41591-021-01553-w
- 掲載日:2021年11月12日(日本時間)
ペルツズマブとトラスツズマブについて
ペルツズマブ及びトラスツズマブは、いずれも腫瘍細胞の増殖に関与するヒト上皮増殖因子受容体2型(HER2)を標的とするヒト化モノクローナル抗体です。
ペルツズマブは、2013年に効能又は効果を「HER2 陽性の手術不能又は再発乳癌」として発売され、2018年の「HER2陽性の乳癌における術前・術後薬物療法」に対する追加承認により、効能又は効果が「HER2陽性の乳癌」へ変更されています。トラスツズマブは、2001年に効能又は効果を「HER2過剰発現が確認された転移性乳癌」として発売され、2011年に「HER2過剰発現が確認された治癒切除不能な進行・再発の胃癌」、2021年に「HER2陽性の根治切除不能な進行・再発の唾液腺癌」に対する追加承認を取得しています。
研究費
国立研究開発法人日本医療研究開発機構(AMED)
臨床研究・治験推進研究事業
「産学連携全国がんゲノムスクリーニング(SCRUM-Japan)患者レジストリを活用したHER2陽性の切除不能・再発大腸がんを対象にした医師主導治験」(研究代表者:吉野 孝之)
革新的がん医療実用化研究事業
「血液循環腫瘍DNA解析を活用した切除不能・進行再発大腸がんにおけるがんゲノム異常のClonal Evolutionに関する網羅的カタログの作成」(研究代表者:中村 能章)
臨床研究・治験推進研究事業
「産学連携全国がんゲノムスクリーニング(SCRUM-Japan)を利用したがん新薬開発に資する疾患登録システムの構築」(研究代表者:大津 敦)
用語解説
*1 希少なサブタイプ
比較的頻度が高いがんの中で、まれな遺伝子変異が認められる病型。「希少がん」は罹患率によって定義されるため、特定の遺伝子異常等を有するがんを論ずる場合には「希少なサブタイプ」という用語を用いる。
参考)令和3年3月31日薬生薬審発0331第1号「抗悪性腫瘍薬の臨床評価方法に関するガイドライン」について(外部サイトにリンクします)
*2 アンメットメディカルニーズ
いまだに治療法が見つかっていない疾患に対する医療ニーズのこと。
*3 SCRUM-Japan(Cancer Genome Screening Project for Individualized Medicine in Japan)
2013年に開始した肺がん患者さんを対象としたLC-SCRUM-Japan(現:LC-SCRUM-Asia)と、2014年に開始した消化器がん患者さんを対象としたGI-SCREEN-Japan(現:MONSTAR-SCREEN)が統合した、産学連携がんゲノムスクリーニングプロジェクト。固形がん患者さんを対象に、がんの遺伝子異常を調べるプロジェクトであり、2015年2月の設立以降、約3万例を超える進行固形がん患者さんが研究に参加。本プロジェクトの成果として、既に11品目の医薬品と9種類の体外診断薬の薬事承認を取得している。全国から200を超える医療機関と17社の製薬企業や検査会社が参画し、アカデミアと臨床現場、産業界が一体となって、日本のがん患者さんの遺伝子異常に合った治療薬や診断薬の開発を行っている。
*4 レジストリ研究
ある条件を満たしている多くの患者さんにおいて、診療で行う検査で得られるデータを集め、集計及び解析をし、将来、同じ病気の患者さんの診療に役立てることを目的とする登録研究。
*5 IHC法
Immunohistochemistryの略語であり、免疫組織化学的染色である。抗体を用いて、組織標本中の抗原(タンパク)を検出する方法。
*6 FISH法
Fluorescence in situ hybridizationの略語であり、蛍光物質や酵素などで標識したオリゴヌクレオチドプローブを用い、目的の遺伝子と交雑させて蛍光顕微鏡で遺伝子異常を検出する方法。
*7 コンパニオン診断薬
特定の薬剤の効果や副作用のリスクなどを予測する検査に使用される薬。
*8 TRIUMPH試験 実施施設(全国7施設)
北海道大学病院、愛知県がんセンター、四国がんセンター、九州がんセンター、大阪医療センター、国立がん研究センター中央病院、国立がん研究センター東病院
問い合わせ先
取材・報道関係からのお問い合わせ
国立研究開発法人国立がん研究センター 企画戦略局 広報企画室(柏キャンパス)
電話番号:04-7133-1111(代表) FAX:04-7130-0195
Eメール:ncc-admin@ncc.go.jp
AMED事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構
・創薬事業部 規制科学推進課 臨床研究・治験推進研究事業
電話番号:03-6870-2235 Eメール:rinsho-crt@amed.go.jp
・疾患基礎研究事業部 疾患基礎研究課 革新的がん医療実用化研究事業
電話番号:03-6870-2286 Eメール:cancer@amed.go.jp
からの記事と詳細 ( アンメットメディカルニーズのHER2陽性大腸がんに対して、世界初の有効な治療法が国内で承認 - 国立がん研究センター )
https://ift.tt/FrZqH9k
0 Comments:
Post a Comment